第六节 蛋白质的细胞定位
一、蛋白质合成后的去向和命运
(一)蛋白质合成的定位
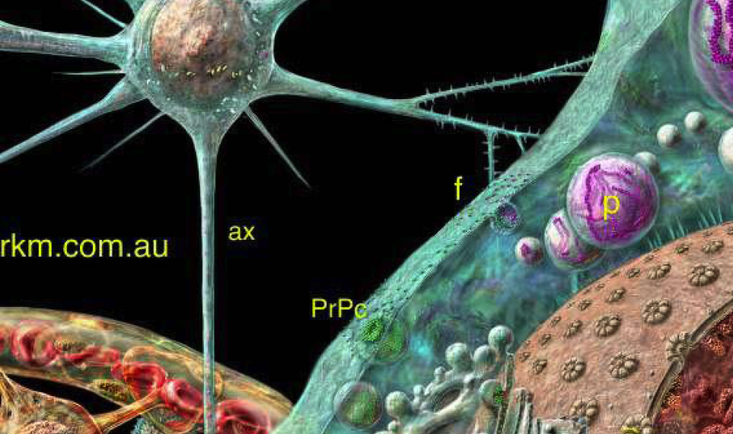
一类是由细胞质溶质内游离核糖体合成的蛋白质:
其从核糖体上合成后释放出来再行转运,为翻译后转移 !
另一类是由附着在内质网上的核糖体合成的蛋白质:
其合成与转运同时进行,此运转方式称为共翻译转移 !


2. 糙面内质网上核糖体所合成的蛋白质:
(1) 运往细胞外的分泌蛋白;
(2) 进入溶酶体腔形成溶酶体酶等;
(3) 留在或运回RER腔中的网质蛋白;
(3) 插入到内质网膜中,并随膜流进入内膜系统各区和质膜,形成它们的结构成分。
(三)蛋白质运送的几种机制
一般,核糖体上所合成蛋白质的氨基酸序列中均含有分拣信号(sorting signal)——决定它们的去向和最终定位
这种依靠氨基酸序列中的分拣信号决定蛋白质的去向和最终定位的分拣机制称为蛋白质分拣(protein sorting)。
具有专一分拣信号的蛋白质可以被运送到细胞内的各个不同部位;而缺乏分拣信号的蛋白质则一直保留在细胞质溶质中。
具有分拣信号的蛋白质在细胞内区间的运送大体有3种不同的基本途径:
1. 孔门运输(gated transport):细胞核、质间的蛋白质运输。
2. 跨膜运输:是通过结合在膜上的蛋白质转移器(protein transportor)直接穿膜把蛋白质从细胞质溶质运送到细胞内的不同部位。必须去折叠(unfold)。
3. 膜泡运输:经过运输膜泡的过渡,把蛋白质从一个区间运送到另一个区间。
1. 孔门运输(gated transport):
2. 跨膜运输:
3. 膜泡运输:
二、蛋白质运输的信号理论
(一) 信号学说
细胞质中共同的核糖体库亚基(60S, 40S):一部分游离在细胞质溶质中;另外附着在RER和核膜外表面
1971年, G. Blobel和D.Sabatini首先对此提出了有关分泌蛋白合成机制的信号假说(signal hypothesis)。
1975年,Blobel成功地破译了第一个信号肽序列,同时还提出在内质网膜上存在允许多肽链通过的通道,证实了那些被分泌到细胞外的蛋白质都将经过通道进入内质网腔。
20世纪80年代初又发现了信号识别颗粒及其受体。
信号假说认为,分泌蛋白、溶酶体蛋白和膜整合蛋白的翻译——穿膜活动同以下几种因素有关:
1、为分泌蛋白编码的mRNA普遍带有信号序列,即mRNA核苷酸链在紧接起始密码子之后有一段编码疏水性氨基酸的序列,称为信号密码子。信号密码子序列的翻译产物是信号肽(signal peptide),长度为10~30个氨基酸不等。
所有蛋白质的合成都是在游离核糖体上开始的,非分泌蛋白的新生肽链中由于没有信号序列,所以不能和糙面内质网膜结合。
2、在糙面内质网膜中存在着一种蛋白质翻译耦联易位系统,它与合成分泌蛋白的核糖体结合到糙面内质网膜上密切相关。
已发现在这个系统中有两种成分:信号识别颗粒 (signal recognition particle, SRP)和信号识别颗粒受体(SRP receptor)。
 SRP是11S的核糖核蛋白复合物,由6条不同分子量的多肽链和1条7S scRNA组成。
SRP是11S的核糖核蛋白复合物,由6条不同分子量的多肽链和1条7S scRNA组成。

3、在RER膜上还存在有核糖体受体,为插在RER膜上的一种整合蛋白。核糖体通过与核糖体受体结合而结合到RER膜上。
核糖体与核糖体受体结合后,SRP与SRP受体脱离, SRP参与再循环。肽链合成又可继续进行。
4、信号肽穿膜并整合到RER膜上,介导新生肽链沿蛋白质转运体穿膜进入RER腔内。
遇到终止密码子后,核糖体大小亚单位解离,并从RER膜中的核糖体受体上及mRNA上脱离下来,肽链合成结束。

核糖体-mRNA-信号识别颗粒复合体结合到内质网膜之后,大多数位于可溶性蛋白氨基末端的信号肽序列还附带有开启转移通道的功能,而且在合成的多肽链完全穿过膜之前,信号肽序列一直结合在通道上
5、ER膜内表面的信号肽酶将信号肽切除,使整个肽链游离于RER腔中。

 20世纪90年代初,Blobel又以确凿的实验证据进一步证明,在RER膜上存在允许多肽链穿过的蛋白质通道
20世纪90年代初,Blobel又以确凿的实验证据进一步证明,在RER膜上存在允许多肽链穿过的蛋白质通道
通道的直径只有2nm左右,所以蛋白质跨膜时必须去折叠以线性方式通过膜。
当带有新生多肽链的核糖体结合到内质网膜时,膜上的蛋白质通道开放,信号肽引导新生肽链穿过这一通道;蛋白质转移完成,核糖体从膜上移走之后,通道关闭。
G. Blobel因此项创见而荣获1999年诺贝尔奖!信号学说 (signal theory)
信号学说 (signal theory)要点:
1、信号肽(由信号密码子编码)
2、信号识别颗粒 / 信号识别颗粒受体
3、核糖体受体(核糖体亲和蛋白)
4、蛋白质转运通道 / 信号肽引导新生肽链穿过通道
5、信号肽酶(合成结束后切除信号肽)
(二)指导蛋白质定位运转的信号序列
被运输的蛋白质一般都带有分拣信号(sorting signal),它可被细胞器上的受体蛋白所识别。
分拣信号是一段连续的氨基酸序列,长达15-60个氨基酸。蛋白质运送到目的后,分拣信号的任务即完成,信号序列就被相应的蛋白酶切去。这样的分拣信号通常也叫做信号序列或引导序列(signal seguence或leader sequence)。
不同类型的信号序列可引导蛋白质在细胞内达到不同的目的地。
几种典型的分拣信号序列(前导序列)

信号序列具有指导一种蛋白质定位到细胞内特定部位所需要的全部信息。如把进入RER的N-端信号肽连接到细胞质溶质蛋白的起始端,就会使该蛋白质改变输方向,转运而进入内质网。
通常,专一定位于相同目的地的一些信号序列,即使在组成上有所不同,但却可具有相同的功能。这是因为,信号序列的一些物理性质,如疏水性、带电荷氨基酸所在的位置等状况,要比氨基酸序列的精确性更重要。
三、分子伴侣在蛋白质折叠和运转中的作用
1987年R. J Ellis便把凡是能够促进其它蛋白质正确折叠和组装的一类蛋白质分子统称为分子伴侣(molecular chaperone)。
分子伴侣定义:在蛋白质折叠和组装过程中,能够防止
多肽链链内和链间的错误折叠或聚集作用,且还可以破
坏多钛链中已形成的错误结构并帮助其正确折叠,但其
自身并不参加最终产物的组成的一类蛋白质分子。
(一)分子伴侣的类别
分子伴侣是进化上相当保守的一类蛋白质家族,目前已被确认的有热休克蛋白Hsp60、Hsp70和Hsp90等。它们广泛分布于原核细胞和真核细胞的细胞质、线粒体和内质网中。
热休克蛋白家族的这几种成员都是恒定型表达的蛋白,为细胞正常生长和增殖所必需。它们不仅在热激反应中表达,而且在其它多种非生理条件的环境中也可合成。
甚至在非热休克细胞中也存在着由热休克基因shp编码的类似蛋白质。

(二) 分子伴侣的基本结构和作用机理
1、Hsp70分子伴侣系统
Hsp70是进化上最保守的蛋白质之一。Dnak是Hsp70家族中首先被确定的成员,它分子量为70 kDa,由两个结构域组成:一个是N端分子量为44kDa高度保守的ATPase结合功能域,另一个是25 kDa的C端区域。
Hsp70的主要功能是防止蛋白质聚集和协助折叠错误的蛋白质重新折叠。此外它还有另外一些作用:

2、Hsp60伴侣蛋白系统
Hsp60在不同的生物中有不同的名称,在线粒体中称为Hsp60;在脊椎动物的细胞质溶质中的称为TCP-1,而在细菌中的则称为Gro EL 。
根据X-射线衍射对结构进行测定,GroEL是由14个亚基组成的寡聚体(EM下呈球形颗粒状),这些亚基排列成方向相反的两个环(每个环由7个亚基组成)。两个环彼此背靠背相接,构成具有中央空腔的筒状结构(腔直径约4.5nm)。
在大肠杆菌的GroEL(伴侣蛋白, chaperonin)和GroES (辅伴侣蛋白, co-chaperonin)相互作用中,底物蛋白与GroEL周期性地结合与释放。在每次结合期间,底物蛋白发生折叠,直到底物蛋白获得其天然构象后,GroES 才与GroEL解离,底物蛋白被释放(依赖于ATP水解)。
体外和体内研究均证实:GroEL和GroES在蛋白质折叠过程中可以防止形成聚集物,提高底物蛋白的正确折叠率。

GroEL双环背靠背地组合成一中空圆筒,GroES形成一圆帽盖在筒的一端
蛋白质底物结合到远环的腔中发生折叠
至于辅伴侣蛋白GroES的作用,除可以提高GroEL结合和催化ATP水解的协同性外,它与GroEL的结合还有促进底物蛋白释放的作用。
真核生物中的Hsp60与原核生物中GroEL的结构和功能基本类似。


一个新生多肽链要依赖于一个或多个分子伴侣的依次作用,最后才能折叠成有特定三维结构并具有生物功能的蛋白质分子 !
(三)分子伴侣在蛋白质定位和跨膜运转中的作用
在细胞质溶质中游离核糖体上合成的蛋白质,除有些贮留在细胞质溶质中外,其它均需运送到细胞内的各种细胞器中。
这些转运到线粒体、质体、内质网等固定空间的蛋白质,都是以未折叠或部分折叠的构象穿过膜到达其行使功能的部位。
前体蛋白在运送时必须保持其伸展构象,并不得聚集变性和降解,以便向细胞器中运输。
分子伴侣不仅能防止新生蛋白的折叠,还能参与蛋白质的转移过程,并帮助线粒体和内质网中新输入的蛋白质正确折叠成一定构象。
Hsp70以一种类似棘轮(ratchet)旋转的分子机制来促进多肽在蛋白质通道(proteinaceous channel)内滑过。多肽的前导链在线粒体腔内一露头,基质中的另一种Hsp70(mHsp70)立即与多肽链的适当片段结合,这样既可防止其后退滑回细胞质,又可便于有更多的mHsp70与肽链结合,拖拽前导链,将整条未折叠的多肽链拖进线粒体基质中。随后,mHsp70利用ATP水解能将多肽链释放。然后,未折叠的蛋白质被转交给线粒体Hsp60(mHsp60),由mHsp60指导蛋白质折叠成正常的自然状态。
四、内质网途径的蛋白质合成及其命运

在RER膜上核糖体合成的蛋白质有两种类型:即跨膜蛋白(transmembrane protein)和水溶性蛋白。
跨膜蛋白通常只是部分穿膜,插入膜中成为膜蛋白,多数随膜流转变成质膜或其它细胞器的膜成分。
水溶性蛋白则完全穿过释放到内质网腔中, 这些不同的新生蛋白质除一小部分存留于内质网腔中外,大部分都要通过膜腔外运,进入其它细胞器腔或排到细胞外。如血浆蛋白和一些蛋白酶原等。
尽管RER核糖体所合成蛋白质的命运有所不同,但它们在合成和运送中都具有某些共同的特点:
它们都具有相同类型的信号肽,能指导它们同RER膜结合,并穿过RER膜进入RER腔;
这些蛋白质的穿膜过程和多肽的延伸相结合,翻译与转移同步进行,是以共翻译转移(co-translational translocation)的形式完成蛋白质的合成过程。
(二) 可溶性蛋白质的合成和转移
信号学说 (signal theory)
(三)膜整合蛋白的定位机制
进入RER的蛋白质除释放到RER腔内的以外,还有些是嵌入到膜中的跨膜蛋白:
其肽链中一些片段必须穿过脂双层;而另外的一些片段则保留在膜中。
像可溶性蛋白一样,跨膜蛋白的开始转移也为信号肽序列所起动。
但这一转移过程可被肽链中的第二个疏水氨基酸序列—停止-转移序列(stop-transfer sequence)所阻断,使肽链不能再继续进入膜中。在进入转移通道后便横移到脂双层中,并形成一个a-螺旋状的跨膜片段,把蛋白质锁定在膜内。
同时,N-端信号肽也从通道释放到脂双层内并被切除。
转移的蛋白质便被作为一个跨膜蛋白定向插入膜中,氨基端朝向脂双层的腔内侧,而羧基端则朝向胞质侧。
有些跨膜蛋白的转移起动,是靠一个内部信号序列而不是氨基末端的信号序列,但这些内部信号序列并不被切除。
有些跨膜蛋白中的疏水信号序列成对行动的组成形式可使肽链来回反复穿过脂双层。这种情况下,一个内部信号序列用来起始转运,另一个是停止转运序列。
起始转移序列与蛋白质转运体结合后,一直等到一个停止转移序列进入转运体时,这两个a-螺旋的疏水序列才被释放到脂双层中,形成2次穿膜的跨膜蛋白。
(四)进入内质网腔内的蛋白质的命运
已转移到内质网腔内的多肽链经进一步折叠、组装和修饰后,它们的最终命运不同,这既取决于多肽链中氨基酸序列所包含的定位信息,也取决于多肽链的修饰状态。
1. 内质网驻留蛋白(ER resident protein)
驻留在内质网中的蛋白在其羧基末端常有一个由4个氨基酸组成的驻留信号序列:
动物中多为Lys-Asp-Glu-Leu (KDEL);
酵母中则为His-Asp-Glu-Leu (HDEL);
植物中序列不固定。
内质网膜上存在有驻留信号序列(KDEL)的受体,可特异性识别KDEL,将其浓缩后出芽,以胞内膜泡形式沿微管运往Golgi复合体进行加工修饰,尔后再反运回RER。
2. 新生肽链在糙面内质网腔中的修饰加工
进入糙面内质网腔中的许多蛋白质,大都要进行修饰加工,如分泌蛋白的糖基化等。
在内质网上合成的蛋白质,大部分为糖蛋白,而在细胞质溶质中合成的可溶性蛋白质则不加接糖基。
糖基化作用对于指导大分子运送到细胞内的其它部位也有重要意义。
五、游离核糖体上合成的蛋白质的归宿
在细胞质溶质核糖体上合成的多肽,除部分贮留在细胞质中外,多数最终要被运送到靶细胞器中,它们在很大的程度上决定了细胞器的结构与功能。
由于细胞器种类不同,相应蛋白质到靶细胞器的定位过程也不尽相同。但它们的转运机理与内质网膜上合成的蛋白质的转运基本相同,都需要有肽链信号序列的引导。
一)核定位蛋白的入核转运
胞质中合成的一些多肽经核孔复合体进入细胞核要依赖于蛋白质本身所携带的核输入信号(nuclear import signal),此信号是蛋白质入核所必需的关键序列。
核输入信号是由4~8个氨基酸构成的一个短肽,富含Lys、Arg和Pro等带正电的氨基酸。
它与信号肽不同的是:
①可以定位在亲核蛋白的不同部位,不仅仅位于N-末端;
②进入核后也不被切除(成为蛋白质的永久构成部分)。

核孔转运蛋白大都含有一些氨基酸重复序列:苯丙氨酸-甘氨酸(FG)肽重复序列 。GDP-Ran的存在使运载物-输入蛋白复合物稳定(它们存在于胞质),而GTP-Ran的存在使运载物-输入蛋白复合物去稳定而解离(它们存在于核质),从而释放运载物。
(二)线粒体蛋白质的跨膜运送
(1)在细胞质溶质中合成多肽前体物;
(2)前体物和细胞器表面的受体结合;
(3)穿过并移进细胞器膜;
(4)前体物被加工成成熟多肽。
这些蛋白质的合成和输入细胞器大体上要涉及到4个步骤:
有些蛋白质进入细胞器的跨膜运动也是利用信号机制。
1. 线粒体蛋白的跨膜运动
(1)线粒体蛋白的前导序列及其受体
由胞质溶质运送到线粒体或叶绿体的蛋白质,输入前是以前体蛋白的形式存在。
前体蛋白在氨基端有一段信号序列(signal sequence)。各种信号序列的长短不等,约为20-80个氨基酸残基,在线粒体蛋白质的跨膜转运中起着关键作用。
线粒体前导序列的特点是:
① 含有较为丰富的带正电荷的碱性氨基酸(特别是精氨酸),穿插在不带电荷的氨基酸序列之间,对牵引蛋白质跨膜具有重要作用 ;
② 不含或基本不含带负电荷的酸性氨基酸;
③ 序列中羟基氨基酸(尤其是丝氨酸)的含量较高;
④ 整个前导序列可形成既具亲水性又具疏水性的两性(amphipathic)a-螺旋,这样,可凭借外正内负的膜电位,使前导肽及其所牵引的蛋白质得以顺利通过膜。
线粒体蛋白质前导序列跨膜运送时,首先被其外膜上的受体蛋白识别并相互结合,在电化学梯度势能的驱动下跨过内、外膜的接触点(membrane contact site),尔后靠ATP水解能进一步进入线粒体基质。
(2)线粒体跨膜蛋白的分拣定位
跨越线粒体双层膜的蛋白质还需进一步分别定位于内膜、外膜和膜间隙。
线粒体前导序列的不同部位在蛋白质的跨膜运输过程中发挥着不同的作用。
也就是说前导肽不仅能引导其所在蛋白质进入线粒体,而且还含有指导蛋白质到达细胞器中一定的空间结构部位的不同导向信息。

Hsc70(组成性表达HSC70(heat shock cognate protein))属于分子伴侣和热激蛋白家族,具有分子伴侣的功能,帮助新合成的蛋白质进行折叠和装配。



3、外膜蛋白质的输入
此类蛋白质前体中在N末端基质定位序列之后,接着为一段长的疏水性氨基酸片段(一个停止转移信号),可阻止蛋白质进入基质,同时可使蛋白质结合到外膜中,成为外膜整合蛋白。此途径中,蛋白质输入后,其基质定位序列和内部疏水性序列均不切除。



在细胞质溶质中合成的线粒体蛋白质并不都是通过前述途径来运送的。
定位于线粒体外膜的蛋白质有时就无前导序列,它不以前体形式运送插入。
而细胞色素c可能是直接扩散通过外膜而进入线粒体,再在细胞色素c-血红素裂合酶催化下,加上血红素后成为成熟型并定位于内膜外侧。
线粒体蛋白质的跨膜运送是一个多步骤的耗能过程,有多种蛋白质参与。
除前导序列可驱动蛋白质前体跨越内外膜并定位于各最终场所外,分子伴侣对于蛋白质跨膜前的解折叠和跨膜后的重新折叠发挥了关链作用。
(三)叶绿体蛋白质的跨膜运送
叶绿体蛋白质跨膜运送的特点:
叶绿体蛋白质的跨膜运送也与线粒体蛋白类似。二者都是翻译后转移,跨膜转运过程都需要能量驱动,在氨基末端都具有两种前导序列,而且在蛋白质进入目的地的过程中被分次切除。
1、叶绿体间质蛋白的输入
叶绿体间质(stroma)中与卡尔文循环有关的酶,除了核酮糖1,5二磷酸羧化酶(rubisco)的大亚基是由叶绿体DNA编码、间质核糖体合成外,其小亚基和所有参与卡尔文循环的酶均由核基因编码、在细胞质溶质中合成,然后输入叶绿体间质中。
这些蛋白质都含有间质输入序列(stromal-import sequence),此序列富含丝氨酸、苏氨酸和疏水性残基,少谷氨酸和天冬氨酸。
核酮糖1,5二磷酸羧化酶小(S)亚基去折叠后进入间质腔,与间质Hsc70分子伴侣暂时结合,N末端输入序列被切除。
2、类囊体腔蛋白的输入
质体蓝素和其他一些类囊体腔蛋白质,肽链中含有两个连续的摄取-定位序列(uptake-targeting sequence)。第1个是N末端间质输入序列,引导蛋白质前体进入间质。第2个是类囊体定位序列(thylakoid-targeting sequence),引导蛋白质进入类囊体腔。
类囊体腔蛋白的输入途径有4条:
① SRP依赖途径
② 利用与细菌SecA相关蛋白质的途径
③ 依赖于与线粒体Oxa 1相关蛋白质的途径
④ ΔpH 途径
这4条途径均与细菌中的蛋白输入途径类似.




(四) 过氧化物酶体中的蛋白质输入
过氧化物酶体中,无论是膜上还是腔中的蛋白质都是在细胞质溶质中合成后输入的。
绝大多数过氧化物酶体基质蛋白的C末端含有SKL(Ser-Lys-Leu)序列,此序列称为过氧化物酶体定位序列(peroxisomal-targeting sequence, PTS 1)。
当把这一短的信号序列连接到细胞质中的任何蛋白质上,都可使该蛋白质被输入过氧化物酶体中。
在细胞质溶质中,PTS 1与可溶性和膜结合的受体蛋白Pex14结合,在功能上与SRP和SRP受体使定位于ER腔的蛋白质输入机制类似。
输入蛋白结合着Pex5通过多体转移通道。在进入基质过程中或进入基质之后,Pex5与过氧化物酶体蛋白质解离,返回细胞质。但PTS1序列不切除。蛋白质输入过程需要水解ATP。

第4步:在基质蛋白转移过程中或在腔内,Pex5与基质蛋白解离,返回细胞质溶质中,返回过程中还要涉及到Pex10/Pex12/Pex2复合物和另外一些膜蛋白及细胞质溶质蛋白质。
输入过氧化物酶体的蛋白质以折叠状态穿膜,在穿膜之前即以折叠构象结合血红素。根据推测,装配的转移通道孔径大小不同,以准确适合携带PTS1的不同大小的分子穿膜。
人类Zellweger综合征(Zellweger syndrome)即是由于过氧化物酶体中缺乏输入蛋白,导致该细胞器产生缺陷。病人细胞内含有“空的”过氧化物酶体,脑、肝、肾严重异常,出生后很快死亡。


六、蛋白质的降解
细胞中的蛋白质也有一定的寿命,一些受损伤、衰老失效和折叠错误的蛋白质要被降解。因而细胞中特定蛋白质的合成与降解,保持了蛋白质量的动态平衡。
(一)蛋白酶体的结构
虽然细胞内大部分损伤蛋白质分子是在细胞质溶质中和溶酶体中分解,但是真核细胞中大多数蛋白质的降解是一种大的细胞质溶质蛋白质水解复合物来执行,这种复合物称为蛋白酶体(proteasome)。
蛋白酶体在结构形态上呈长形,中间为一圆筒,圆筒中央为一腔,其活性部位朝向内腔。
圆筒的两端各盖有一帽状结构,帽是由十几种不同的亚基组成蛋白质复合物,可与要降解的蛋白质结合,将其送入圆筒的中央腔中。
(二)蛋白酶体降解蛋白质的机制
蛋白酶体降解蛋白质的机制与溶酶体和细胞质溶质的不同,前者最主要的特点是在降解蛋白质的途径中,首先要对注定降解的蛋白质在赖氨酸侧链上连接泛素(ubiquitin)分子(由76个氨基酸残基组成的多肽),这一变化被称为泛素化(ubiquitinazition)。
泛素化要经过3步:
1、泛素激活酶(E1)的激活 此反应是通过添加泛素分子发生的,需要ATP。
2、泛素分子转移 泛素分子加接到泛素缀合酶(E2)的半胱氨酸残基上。
3、加接泛素标签 由泛素连接酶(ubiquitin ligase)(E3)催化,在E2结合的泛素分子与将要降解靶蛋白的赖氨酸残基间形成肽键。
此3步反应可反复多次,每次加接上一个泛素分子。

多泛素链可被蛋白酶体‘帽’识别,将带有多泛素链的蛋白质送入蛋白酶体圆筒腔中降解。蛋白质被切割成许多小的肽片段(7~8个残基),而泛素分子保持完整。
复习思考题
1.原核生物的操纵子学说的要点如何?
2.已知的转录调控因子的DNA结合结构域有哪几种,它们的特点何在?
3.RNA编辑的意义何在?
4.RNA 5’-和3’-非翻译区在基因表达调控中有何意义,为什么?
5.信号学说怎样解释蛋白质的定位合成与分解?
6.蛋白质合成的去向如何?
7.蛋白质合成后通过哪些途径运送到其终极目的地?
8.什么叫分子伴侣?举例说明它们在蛋白质定位和跨膜运送中的作用机制。
9.线粒体蛋白的跨膜运输有哪些特点?
10.RER途径的蛋白质合成有何特点?这些蛋白质的归宿如何?
11.膜整合蛋白是怎样定位的?