(三)量子化学与现代化学键理论
(1)元素周期理论的新发展。
电价根据量子力学,描述原子中电子的运动状态需要有四个量子数n,l,ml,ms,其中n为主量子数,它决定着电子的能量大小;l为轨道量子数,它决定着电子绕核运动的轨道角动量的大小;ml磁量子数,决定着轨道角动量在外磁场方向上的分量;ms则是自旋量子数,决定电子自旋角动量在外磁场方向上的分量。
原子中电子的分布满足如下的规律:
①原子中电子的分布是分层次的,叫电子壳层。每个壳层由主量子数n来区分,n=1的壳层叫K壳层,n=2的壳层叫L壳层,依次有M、N、O、P、Q壳层,共7个壳层。
②在每个壳层上,由于能量不同,又可以细分为几个不同的亚层,通常用s、p、d、f等表示,其实实质乃是轨道量子数l的不同,如s对应于l=0,p对应于l=1等。而总的来说,若主量子数为n,轨道量子数l的取值范围为l=0,1,2,…(n-1)。
③电子分布的每个亚层又可再细分为几个不同的轨道,其标志为ml电子的磁量子数ml,而每个轨道上还能容纳两个自旋方向相反的电子,其标志为自旋量子数ms。
④电子在原子中的分布还遵从下列两个原理:①泡利不相容原理,即在一个原子中不可能有两个或两个以上的电子有完全相同的运动状态,也就是说,任何两个电子不可能有完全相同的一组量子数(n,l,ml, m2);②能量最小原理,即在原子系统内,每个电子总是趋向于占有最低的能级;如果有n个相同的轨道,则电子在成对前分别平行填充各轨道,例如有3个p轨道,有3个电子,它们的排布情形将是 ↑↑↑,而不是↑↓↑。当原子中每个电子的能量最小时,整个原子的能量最小,此时原子处于稳定状态,称基态。根据两个原理,每个主壳层上允许容纳的电子数、最多为Zn=2n2,其中n为量子数,如n=2的L壳层上最多容纳电子为8个。同时又知道,每种原子的最外层最多排布8个电子,次外层最多能排布18个电子,外数第三层最多能排布32个电子。
依据上述电子在原子核外的排布规律,人们才揭示出元素周期律的深层本质:元素在周期表中的位置,或者说元素的性质和周期性变化是由原子的电子壳层结构的周期性变化决定的而原子核外电子的总数等于原子核内的质子数或电荷数,即等于原子序数。元素在周期表中的周期数,等于该元素的原子的核外电子的壳层数,即主量子数nmax;而它所处的族,则由最外层电子的个数所决定,同一周期中的元素,从左到右,电子的数目由1变化到8,形成不同的周期,其金属性依次减弱,非金属性逐渐增强,直至惰性气体。而同一族的元素,由于最外层电子数目相同,其化学性质极为相似,但由于它们处在不同的周期,最外层电子离原子核的距离也依次增加,作用力削弱,从而导致在周期表中从上到下,同一族的元素呈现出金属性质的增强或化学活泼性的递增。
(2)现代价键理论
化学键主要有电价键(离子键)、共价键和金属键理论。量子力学诞生以后,出现了分子轨道理论、杂化轨道理论和分子轨道对称理论。
1852年,弗兰克兰(E·Frankland)提出化合力后被称为化合价或原子价。1856年他又提出键的概念来表示原子的结合。
电价键(离子键)理论由柯塞尔1916年提出。电价键是由于离子之间通过静电相互作用而形成的化学键。
共价键理论由路易斯1916年提出。该理论认为,像H2、O2等的分子中,每个原子都不可能完全失去和得到一个电子,于是每个原子就各贡献出一个或多个电子,从而形成一个或多个电子对,两个原子就依靠这些共用电子对结合在一起,这进,对每个原子来说,加上共用电子对,就可使最外层电子形成稳定的结构。
金属键理论是说,由于金属对外层电子的吸引力较弱,成键电子为全体金属离子共用。
(3)量子化学
1927年海特勒和伦敦开创了用量子力学处理原子结构方法,解决了氢分子结构问题。从而建立了量子化学。把价键理论用电子云解释。其特点是电子云是电子在原子中轨道运动的统计结果,电子云重叠越多,共价键越稳定。
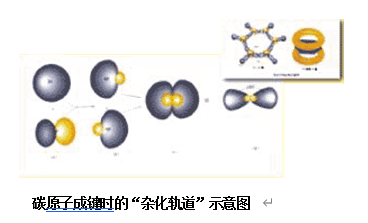
1931年鲍林(L.C.Pauling,1901-1994)等人提出杂化轨道理论。认为波可以叠加,在碳原子成键时,电子所用的轨道不完全是原来纯粹的单一轨道,而两个轨道经过叠加而成的“杂化轨道”。该理论能很好地解释共价键的方向及分子的构型,特别是解释了碳四面体结构。
20世纪30年代初由洪德和伦纳德-琼斯等提出分子轨道理论,认为原子轨道组成了分子轨道,分子中各电子都按分子轨道运动。50年代以后,以莫立根为首的一批科学家用计算机来计算分子轨道,使其得到较快的发展。
1965年伍德瓦德和霍夫曼提出分子轨道对称守恒原理。认为化学反应是分子轨道重新组合的过程,其过程分子轨道是对称守恒的。为解决复杂的化学反应理论问题,而运用的都是简单的模型,尽量不依赖那些高深的数学运算。它们均以简单分子轨道理论为基础,力求提出新概念、新思想和新方法,使之能在更加广泛的范围中普遍适用。例如,“前线轨道”、“等瓣类似”等概念的提出已经显示出重大的意义。多粒子体系问题的处理方法也在不断深入探索。其中密度矩阵理论、多级微扰理论以及运用格林函数方法的传播子理论等则是当前精确求解多粒子体系薛定谔方程的几条值得重视的途径。
价层电子对互斥理论则能根据分子式而推出分子的构型。价层电子对互斥理论可以说是轨道杂化理论的一种逆运算。根据势能曲线,排斥力势能随着价电子对相互距离增大而单调减小。所以价电子对的远离是有其排斥力所决定的。电子对之间的排斥作用是由两种客观存在的力所决定:静电相互作用和泡利斥力(自旋相同的电子不相容)。
